
Informieren Sie sich und bleiben Sie gesund! Ihr Dr. Peter Siemsen
Die nachfolgenden Hinweise beziehen sich auf die in Deutschland und der EU zugelassenen Impfstoffe Comirnaty (BNT162b2) von BioNTech/Pfizer, Covid-19 Vaccine Moderna (mRNA-1273) von Moderna, Vaxzevria (AZD1222) von AstraZeneca und COVID-19 Vaccine Janssen (Ad26.COV2.S) von Janssen-Cilag/ Johnson & Johnson.
Verabreichung der Impfstoffe
Die Impfstoffe werden intramuskulär in den Oberarm injiziert.
Beim Vakzin Comirnaty muss die Impfung in einem zeitlichen Abstand von 21 – 42 Tagen wiederholt werden, um eine vollständige Immunisierung zu erreichen. Eine Impfdosis (Volumen: 0,3 ml) enthält 30 µg mRNA für Personen ab 12 Jahren und 10 µg mRNA für Kinder im Alter von 5-11 Jahren [58].
Der Impfstoff Covid-19 Vaccine Moderna wird ebenfalls zweifach verabreicht im Abstand von 28 – 42 Tagen. Eine Impfdosis hat ein Volumen von 0,5 ml.
Beim Vakzin Vaxzevria wird die zweite Impfung 4-12 Wochen nach der Erstimpfung durchgeführt.
Der Impfstoff COVID-19 Vaccine Janssen wird nur einmal verabreicht.
Vakzine unterschiedlicher Hersteller sollten nicht kombiniert werden, da Nebenwirkungen und Wirksamkeit entsprechender Wirkstoffkombinationen derzeit nicht ausreichend untersucht wurden. Falls in den beiden Impfdurchgängen fälschlicherweise Impfpräparate unterschiedlicher Hersteller verabreicht worden sind, wird ein Impfabschluss durch erneute Gabe einer der verwendeten Vakzine aktuell nicht empfohlen.
Angesichts der in Deutschland seit dem 31.03.2021 ausgesetzten Verimpfung des Impfstoffs von AstraZeneca an Unter-60-Jährige empfiehlt die STIKO, Personen dieser Altersgruppe, die bereits eine Erstimpfung mit diesem Vakzin erhalten haben, beim zweiten Impfdurchgang die mRNA-Impfstoffe Comirnaty oder Covid-19 Vaccine Moderna zu verabreichen [54].
Halt- und Handhabbarkeit der Impfstoffe
Comirnaty ist bei -60 °C (bis – 90 °C) bis zu 6 Monate haltbar. Die Lagerfähigkeit nimmt mit steigender Temperatur deutlich ab: Bei Kühlschranktemperatur (2 – 8 °C) sinkt die Haltbarkeit auf 5 Tage, bei 30 °C auf 2 Stunden. Pro Vial (Injektionsfläschchen) können nach aktueller Zulassung 5-6 Impfdosen gezogen werden. Hierzu sind spezifische Spritzen und Kanülen erforderlich (z.B. Insulinspritzen).
Covid-19 Vaccine Moderna weist deutlich höhere Temperaturstabilität auf: Im Temperaturbereich von –25 bis –15 °C ist der Impfstoff 7 Monate lagerfähig. Bei 2 bis 8 °C beträgt die Haltbarkeit 30 Tage und bis 25 °C 12 Stunden. Ein Vial enthält 10 Impfdosen, die mit gängigen Einwegspritzen und Kanülen aufgezogen werden können.
Vaxzevria ist bei Kühlschranktemperatur (2 – 8 °C) mindestens 6 Monate haltbar.
COVID-19 Vaccine Janssen kann bei Kühlschranktemperaturen (2 – 8 °C) mindestens 3 Monate gelagert werden.
Derzeitiges Mindestalter
Der Impfstoff Comirnaty wurde von der EMA am 25.11.2021 für Kinder ab 5 Jahren zur Zulassung empfohlen; das für die Zulassung notwendige Votum der EU-Kommission wird zeitnah erwartet. Für die Altersgruppe der 5-11-Jährigen ist das Vakzin niedriger dosiert (10 µg mRNA pro Dosis) [58]. Die STIKO empfiehlt die Verabreichung des Impfstoffs Kindern im Alter von 5 bis 11 Jahren mit Vorerkrankungen. Zusätzlich wird Kindern in dieser Altersgruppe die COVID-19-Impfung empfohlen, wenn sich in deren Alltags- bzw. Lebensumfeld Kontaktpersonen mit einem hohen Risko für einen schweren Corona-Krankheitsverlauf befinden. Eine uneingeschränkte Empfehlung der STIKO für die Impfung mit Comirnaty liegt bisher erst für Personen ab 12 Jahren vor. Impfstart mit dem niedrig dosierten „Kinder-Impfstoff“ in Deutschland war am 15.12.2021 [59]. Covid-19 Vaccine Moderna ist aktuell für Personen ab 12 Jahren zugelassen. Auf Basis der wissenschaftlichen Datenlage erweiterte die STIKO am 16.08.2021 ihre Impfempfehlung für die beiden mRNA-Impfstoffe Comirnaty und Covid-19 Vaccine Moderna auf 12- bis 17-Jährige.
Für Vaxzevria beträgt das zugelassene Mindestalter 18 Jahre.
Beschluss von Bund und Ländern vom 30.03.2021 zum Einsatz des Impfstoffes von AstraZeneca:
Der Corona-Impfstoff von Astrazeneca soll in Deutschland ab dem 31.03.2021 nur noch für Menschen ab 60 Jahren eingesetzt werden. Personen über 60 sollen vorrangig damit geimpft werden, die Länder können ab sofort auch Personen im Alter von 60-69 Jahren in die Verimpfung dieses Vakzins einbeziehen, um den Impffortschritt in dieser zahlenmäßig großen und gefährdeten Altersgruppe zu beschleunigen. Ein Einsatz unterhalb dieser Altersgrenze bleibt „nach ärztlichem Ermessen und individueller Risikoanalyse und Entscheidung der impfwilligen Person nach sorgfältiger Aufklärung weiterhin möglich.“
Hintergrund der Entscheidung sind die in Deutschland bei jüngeren Impfpatienten (überwiegend Frauen) aufgetretenen Hirnvenenthrombosen. [53] Lesen Sie hierzu auch den Abschnitt Verträglichkeit und mögliche Nebenwirkungen.
Der Impfstoff COVID-19 Vaccine Janssen ist für Personen ab 18 Jahren zugelassen.
Kombination mit anderen Impfungen
Alle Impfstoffe sind Totimpfstoffe. Bei dieser Impfstoffklasse ist normalerweise kein zeitlicher Abstand zu anderen Impfungen erforderlich. Aufgrund bisher fehlender Daten über mögliche Wechselwirkungen oder die Beeinflussung der Wirksamkeit, sollte ein Mindestabstand von 14 Tagen zu anderen Impfungen (wie z.B. Influenza oder Grippe) eingehalten werden.
Wirksamkeit
Comirnaty senkt das Erkrankungsrisiko um durchschnittlich 95%. Zwischen den Altersgruppen bestehen mit 96% (16-55 Jahre) und 94% (>55 Jahre) keine signifikanten Wirksamkeitsunterschiede.
Covid-19 Vaccine Moderna verringert das Erkrankungsrisiko über alle Altersgruppen um durchschnittlich 94%. Die Wirksamkeit war bei Probanden der Altersgruppe 16-55 Jahre mit 96% höher als bei Probanden der Altersgruppe über 55 Jahre (86%).
Vaxzevria senkt gem. der von Public Health England im März 2021 veröffentlichten Studie das Erkrankungsrisiko in der Altersgruppe ab 70 Jahre in den Tagen 28-34 nach der 1. Dosis um 60 %. Die Wirksamkeit steigt danach auf bis zu 73% an. Ausreichende Wirksamkeitsdaten zur 2. Dosis liegen derzeit noch nicht vor.
Die Wirksamkeit von COVID-19 Vaccine Janssen liegt bei 66% über alle Altersgruppen. Bei Menschen mit chronischen Erkrankungen sank diese auf 60%.
Comirnaty verhindert schwere Krankheitsverläufe mit hoher Wirksamkeit.
Die Studie mit Covid-19 Vaccine Moderna zeigt, dass dieses Vakzin das Risiko für einen schweren Verlauf deutlich verringert.
Vaxzevria verhindert schwere Krankheitsverläufe ebenfalls mit hoher Wirksamkeit: Von den Geimpften zeigten deutlich weniger Personen schwere Beschwerden auf, die einen Krankenhausaufenthalt erforderten.
COVID-19 Vaccine Janssen senkt das Risiko für einen schweren Verlauf deutlich (um 85 %).
Wechselwirkungen mit anderen Medikamenten
Für die Impfstoffe wurden bisher keine Studien zur Erfassung von Wechselwirkungen durchgeführt.
Verträglichkeit und mögliche Nebenwirkungen
Bisher liegen für die Impfstoffe keine Hinweise auf mögliche schwere Nebenwirkungen vor. Typische Impfreaktionen wie Schmerzen, Rötungen und Schwellungen im Bereich der Einstichstelle sowie Kopf-, Muskel-, Gelenkschmerzen oder auch Übelkeit, Schüttelfrost und leichtes Fieber können bei allen Vakzinen auftreten. Letztgenannte Symptome zeigen, dass der Körper wie beabsichtigt Abwehrstoffe bildet, was für eine spätere Immunität erforderlich ist. Die Nebenwirkungen sind in aller Regel leicht bis mittel und verschwinden nach wenigen Tagen. Bei den Impfstoffen Comirnaty und Covid-19 Vaccine Moderna wurden sehr selten Lähmungen des Gesichtsnervs (0,02%) und allergische Reaktionen beobachtet (0,1%). Ein direkter Zusammenhang mit der Verabreichung der Impfstoffe ist derzeit nicht belegt. In den Studien mit Vaxzevria und COVID-19 Vaccine Janssen gab es nur vereinzelt schwerere Erkrankungen. Ein Unterschied zwischen geimpften und ungeimpften Personen war dabei nicht feststellbar.
Beim Auftreten der o.g. Impfreaktionen ist die Gabe fiebersenkender oder schmerzstillender Medikamente wie Paracetamol und nicht-steroidaler Antirheumatika (NSAR) wie Ibuprofen möglich, wenn die medizinische Sinnhaftigkeit durch einen Arzt festgestellt wurde.
Zur Überwachung unmittelbar nach der Impfung auftretender Reaktionen werden die geimpften Personen 15 Minuten nach der Impfung durch die Impfstelle beobachtet.
Hinweise zum Impfstoff von AstraZeneca:
Nach Berichten über thromboembolische Ereignisse (Blutgerinnsel) nach Impfungen mit dem Vakzin von AstraZeneca, insbesondere Thrombosen der Hirnvenen, hatte nach einigen europäischen Ländern am 15.03.2021 auch Deutschland die Impfungen mit COVID-19 Vaccine AstraZeneca zunächst ausgesetzt [50]. Es handelte sich um eine vorsorgliche Maßnahme. In Deutschland wurden Hirnvenenthrombosen bei 7 von insgesamt 1,6 Millionen Impfungen gemeldet. Ein kausaler Zusammenhang zwischen den beobachteten Thrombosen und der Verabreichung des Impfpräparats konnte nicht nachgewiesen werden.
Nach der anschließenden Bewertung der Fälle durch die EMA [51] und das PEI [52] wurde der Impfstoff erneut als sicher bestätigt und darf seit 18.03.2021 in Deutschland weiter verwendet werden.
In ihrer Bewertung kam die EMA zu folgenden Schlussfolgerungen:
Zum Bewertungszeitpunkt waren in Großbritannien und Europa rund 20 Millionen Personen mit COVID-19 Vaccine AstraZeneca geimpft worden. Aus den vorliegenden Daten gab es keinen Hinweis, dass Vaxzevria generell das Risiko für Blutgerinnsel erhöht. Bei den bekannten Fällen von ungewöhnlichen Hirnvenenthrombosen waren vor allem Frauen unter 55 Jahren mit einem niedrigen Blutplättchengehalt betroffen. Ein Wirkzusammenhang zwischen Impfstoffgabe und Blutgerinnsel konnte nicht nachgewiesen werden. Die gesundheitlichen Risiken durch COVID-19 sind um ein Vielfaches höher als die Risiken von Nebenwirkungen des Impfstoffs.
Da ein Zusammenhang zwischen dem sehr seltenen Auftreten von Blutgerinnseln und der Verabreichung des Impfstoffs zum aktuellen Zeitpunkt nicht vollständig ausgeschlossen werden kann, wird auf dem Beipackzettel von COVID-19 Vaccine AstraZeneca folgender Warnhinweis ergänzt: „Beim Auftreten der folgenden Symptome innerhalb von 14 Tagen nach der Impfung mit Vaxzevria sollte unverzüglich eine Ärztin oder ein Arzt aufgesucht werden: Atemnot, Schmerzen im Brust- oder Magenbereich, schwere, sich verschlimmernde Kopfschmerzen, beeinträchtigtes Sehvermögen, auffällige kleine Blutergüsse, rot-violette Flecken oder Blutbläschen unter der Haut, anhaltende Blutungen, Schwellungen oder Kälteempfinden in Arm oder Bein.“
Aufgrund der Ende März 2021 verfügbaren Daten zum Auftreten „seltener, aber sehr schwerer thromboembolischer Nebenwirkungen“ in der Altersgruppe unter 60 Jahren innerhalb von 4 bis 16 Tagen nach der Impfung empfahl die Ständige Impfkommission (Stiko) eine Altersbeschränkung für den Impfstoff von Astrazeneca. Bund und Land folgten der Empfehlung mit einem entsprechenden Beschluss am 30.03.2021, das Vakzin nur noch bei Personen zu verimpfen, die älter als 60 Jahre sind [53].
Am 20.04.2021 gaben Mecklenburg-Vorpommern und Sachsen den Impfstoff erneut für alle Altersgruppen frei, Bayern folgte am 21.04.2021.
Hinweise zum Impstoff Janssen von Johnson & Johnson:
Nach dem Aufreten vereinzelter Thrombosen in den USA hatte die EMA nach der Zulassung am 30.03.2021 die Verabreichung des Vakzins zunächst ausgesetzt. Auf Basis der bis Mitte April vorliegenden Daten erteilte die Behörde dem Impfstoff am 20.04.2021 die Freigabe für einen uneingeschränkten Einsatz. In ihrer Beurteilung stellte die EMA fest, dass COVID-19 Vaccine Janssen ähnlich wie der Impfstoff von AstraZeneca in sehr seltenen Fällen Blutgerinnsel hervorrufen kann, der Nutzen allerdings deutlich höher als die Risiken ist [55].
Hinweis:
Im Rahmen von Zulassungsstudien ist die Identifikation von sehr seltenen Nebenwirkungen nicht vollständig möglich. Die Impfstoffe unterliegen einer zusätzlichen Überwachung durch das Paul-Ehrlich-Institut. Deren Sicherheitsberichte sind öffentlich zugänglich unter folgendem Link.
Personen mit Vorerkrankungen und geschwächtem Immunsystem
Für Personen mit Vorerkrankungen wird aufgrund des hohen Risikos für schwere Krankheitsverläufe die Impfung dringend empfohlen. Dieser Personenkreis wurde in die klinischen Studien aufgenommen und zeigte vergleichbare Sicherheits- und Wirksamkeitsprofile wie Probanden ohne Vorerkrankungen.
Zu immungeschwächten Personen (z.B. HIV-Infizierte oder Patienten, die Immunsuppressiva einnehmen) gibt es noch kein abschließenden Daten zu Sicherheit und Wirksamkeit der Impfstoffe. Bei der Entscheidung sollte im Vorgespräch mit diesem Personenkreis auf die Möglichkeit einer reduzierten Immunantwort hingewiesen werden.
Allergiker
Die Impfstoffe dürfen nicht verabreicht werden, wenn schwere Allergien gegen folgende Substanzen (die als Hilfsstoffe enthalten sind) bestehen:
ALC-0315 = (4-Hydroxybutyl)azandiyl)bis (Hexan-6,1-diyl)bis(2-hexyldecanoat)
ALC-0159 = 2-[(Polyethylenglykol)-2000]-N,N-ditetradecylacetamid
2-Distearoyl-sn-glycero-3 phosphocholin
Cholesterol
Kaliumchlorid
Kaliumdihydrogenphosphat
Natriumchlorid
Dinatriumhydrogenphosphat-Dihydrat
Saccharose
Wasser für Injektionen
Falls schwere allergische Reaktionen auf einen anderen Impfstoff oder eine injizierbare Therapie bekannt sind, sollte eine Risikobewertung durchgeführt werden. Eine Impfung dieser Personen kann nach positiver Abwägung von Nutzen und Risiken trotzdem durchgeführt werden. Patienten, die im Zusammenhang mit Impfungen bereits früher schwere allergische Reaktionen, insbesondere eine Anaphylaxie (akute allergische Reaktion des Immunsystems), gezeigt haben, sollten durch die Impfstelle über einen Zeitraum von 30 Minuten nach der Impfung beobachtet werden.
Allergien, die nicht im Zusammenhang mit Impfungen oder injizierbaren Therapien stehen, stellen aus Sicht der Gesundheitsbehörden kein Ausschlusskriterium für die Impfung dar.
Schwangerschaft und Stillphase
Aktuell liegen noch keine Ergebnisse zur Sicherheit der COVID-19-Impfstoffe bei Schwangeren und stillenden Müttern vor. Entsprechende Studien sind in Arbeit.
Da es sich bei den Vakzinen um Totimpfstoffe handelt und (im Fall von Comirnaty bzw. Covid-19 Vaccine Moderna) die Impfstoff-mRNA in der Zelle schnell abgebaut wird, halten die Experten eine mögliche Gefährdung des ungeborenen oder gestillten Kindes für unwahrscheinlich. Eine Schwangerschaft oder auch Stillphase sollte im Aufklärungsgespräch dennoch in jedem Fall angesprochen werden, um festzustellen, ob die schwangere oder stillende Person zu einer Gruppe gehört, für die eine Covid-19-Impfung empfohlen wird (z.B. Pflege-Personal). Bei der Entscheidungsfindung sollte auch berücksichtigt werden, dass trotz eines geringen absoluten Risikos Schwangere nach aktuellen Erkenntnissen ein erhöhtes Risiko für schwere Krankheitsverläufe haben.
Was nach der Impfung zu beachten ist
Sämtliche bisher freigegebene Impfstoffe können die Übertragung von Corona, v.a. im Fall der hochinfektiösen Delta-Variante, nicht vollständig unterbinden. Aktuelle Studien zeigen, dass der Impfschutz nach 6 Monaten deutlich nachlässt (s. u. Grafik) [56]. Daher sollten auch geimpfte Personen die geltenden Hygiene- und Verhaltensregeln zum Infektionsschutz dringend einhalten.
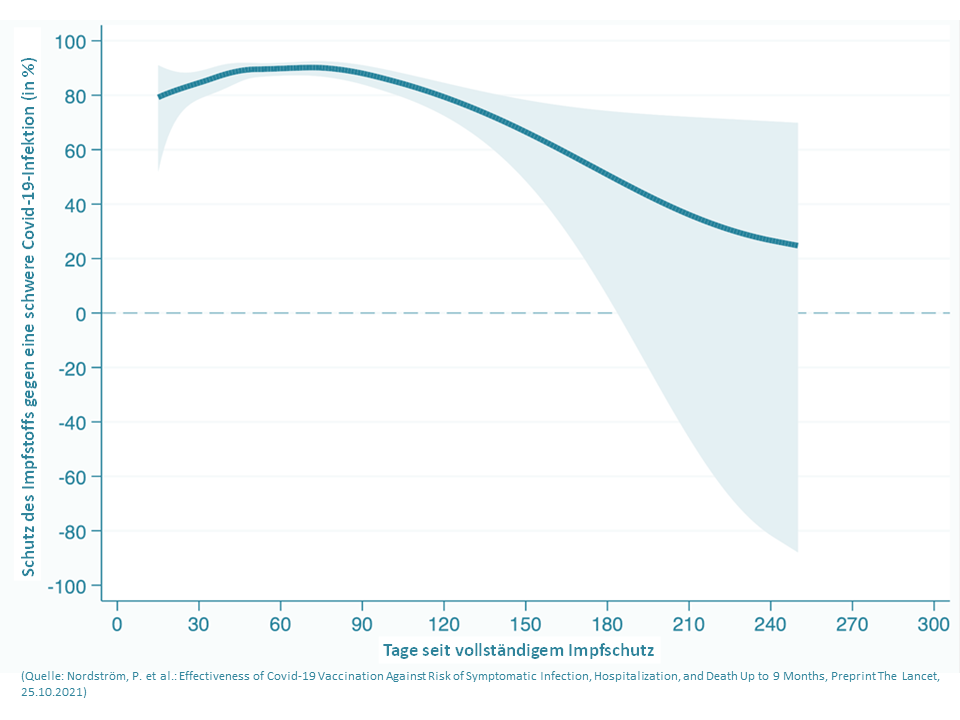
Warum Booster-Impfungen?
Aufgrund des nach 6 Monaten nachlassenden Impfschutzes empfiehlt die STIKO allen Personen ab 18 Jahren eine Auffrischimpfung mit einem mRNA-Impfstoff 6 Monate nach Erhalt der letzten Impfstoffdosis. Diese als Booster-Impfung bezeichnete Auffrischung kann gem. Empfehlung auch bereits 5 Monate nach der letzten Corona-Impfung erfolgen [57].
Bitte beachten Sie: Die hier veröffentlichten Inhalte stammen aus den nachfolgend genannten Quellen. Sie sollen Ihnen einen kompakten Überblick zu den derzeit in Deutschland und der EU zugelassenen Impfstoffen bieten, können aber das vor einer Impfung erforderliche, medizinische Aufklärungsgespräch nicht ersetzen.
Quellen:
[33] T. Dingermann, Pharmazeutische Zeitung 2020, Web-Publikation 18.12.2020, FAQ zum Covid-19-Impfstoff: Praktische Fragen und Antworten rund um den Bi | PZ – Pharmazeutische Zeitung (pharmazeutische-zeitung.de)
[34] P. Meiser, DAZ.online 2021, Web-Publikation 15.01.2021, Biontech/Pfizer versus Moderna: Die zugelassenen mRNA-Impfstoffe im Vergleich (deutsche-apotheker-zeitung.de)
[35] T. Dingermann, Pharmazeutische Zeitung 2021, Web-Publikation 04.01.2021, mRNA-Impfstoffe: Biontechs und Modernas Impfstoffe im Vergleich | PZ – Pharmazeutische Zeitung (pharmazeutische-zeitung.de)
[36] L.R. Baden, H.M. El Sahly, B. Essink B et al., N. Engl. J. Med. 2020, 1-14, Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine.
[37] European Medicines Agency (EMA) 2020, Comirnaty.
[38] European Medicines Agency (EMA) 2021, COVID-19 Vaccine Moderna.
[39] Food and Drug Administration (FDA), Vaccines and Related Biological Products Advisory Committee Meeting December 10, 2020, 2020, FDA Briefing Document. Pfizer-Biontech COVID-19 Vaccine.
[40] Food and Drug Administration (FDA), Vaccines and Related Biological Products Advisory Committee Meeting December 17, 2020, 2020, FDA Briefing Document. Moderna COVID-19 Vaccine.
[41] Pfizer. A Phase 1/2/3, Placebo-Controlled, Randomized, Observer-blind, Dose-finding Study to Evaluate the Safety, Tolerability, Immunogenicity, and Efficacy of Sars-Cov-2 RNA Vaccine Candidates Against Covid-19 in Healthy Individuals (Protocol Number: C4591001), 2020.
[42] Moderna, A Phase 3, Randomized, Stratified, Observer-Blind, Placebo-Controlled Study to Evaluate the Efficacy, Safety, and Immunogenicity of mRNA-1273 SARS-CoV-2 Vaccine in Adults Aged 18 Years and Older, 08.2020.
[43] Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) GI, Der Impfstoff AstraZeneca (AZD1222, AstraZeneca) zur Impfung gegen Corona (gesundheitsinformation.de)
[44] Tagesschau, Web-Publikation 29.01.2021, Coronavirus: EMA gibt AstraZeneca-Vakzin frei | tagesschau.de
[45] Robert Koch-Institut, Epidemiologisches Bulletin 5/2021, Beschluss der STIKO zur 2. Aktualisierung der COVID-19-Impfempfehlung und die dazugehörige wissenschaftliche Begründung.
[46] J. L. Bernal, N. Andrews, C. Gower, J. Stowe, C. Robertson, E. Tessier, R. Simmons, S. Cottrell, R. Roberts, M. O’Doherty, K. Brown, C. Cameron, D. Stockton, J. McMenamin, M. Ramsay, Public Health England, medRxiv 2021, 1-21, Early effectiveness of COVID-19 vaccination with BNT162b2 mRNA vaccine and ChAdOx1 adenovirus vector vaccine on symptomatic disease, hospitalisations and mortality in older adults in England | medRxiv
[47] DAZ.online 17.02.2021, Vierter COVID-19-Impfstoff für die EU: Janssen-Cilag beantragt Zulassung für Ad26.COV2.S (deutsche-apotheker-zeitung.de)
[48] DAZ.online 11.03.2021, COVID-19-Impfstoff Janssen: EMA empfiehlt die Zulassung des vierten COVID-19-Impfstoffs (deutsche-apotheker-zeitung.de)
[49] Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) GI, Der Impfstoff Janssen (Janssen-Cilag, Johnson und Johnson) zur Impfung gegen Corona (gesundheitsinformation.de)
[50] C. Hohmann-Jeddi, Pharmazeutische Zeitung 2021, Web-Publikation 15.03.2021,Impfstoffsicherheit: Impfungen mit Astra-Zeneca in Deutschland ausgesetzt | PZ – Pharmazeutische Zeitung (pharmazeutische-zeitung.de)
[51] Europeans Medicines Agency, Nachrichten 18.03.2021, COVID-19 Vaccine AstraZeneca: benefits still outweigh the risks despite possible link to rare blood clots with low blood platelets | European Medicines Agency (europa.eu)
[52] Paul-Ehrlich-Institut, Meldung 19.03.2021, Paul-Ehrlich-Institut – Meldungen – COVID-19-Impfstoff AstraZeneca – Ergebnis der Sicherheitsbewertung: Der Impfstoff ist sicher und wirksam im Kampf gegen COVID-19 (pei.de)
[53] Der Tagesspiegel vom 30.03.2021, Beschluss von Bund und Ländern: Astrazeneca-Impfstoff ab Mittwoch nur noch für über 60-Jährige – Berlin – Tagesspiegel
[54] D. Hüttemann, Pharmazeutische Zeitung 2021, Web-Publikation 01.04.2021,Neue STIKO-Empfehlung: Keine Zweitimpfung mit Astra-Zeneca neuer Impfabst | PZ – Pharmazeutische Zeitung (pharmazeutische-zeitung.de)
[55] D. Hüttemann, C. Hohmann-Jeddi, Pharmazeutische Zeitung 2021, Web-Publikation 20.04.2021,Trotz Thrombosen: EMA gibt grünes Licht für Covid-19-Impfstoff von Janssen | PZ – Pharmazeutische Zeitung (pharmazeutische-zeitung.de)
[56] P. Nordström, M. Ballin, A. Nordström, Effectiveness of Covid-19 Vaccination Against Risk of Symptomatic Infection, Hospitalization, and Death Up to 9 Months, Preprint The Lancet vom 25.10.2021, https://papers.ssrn.com/sol3/Delivery.cfm/SSRN_ID3949410_code2488747.pdf?abstractid=3949410&mirid=1&type=2
[57] Pressemitteilung der STIKO zur Auffrischimpfung einer COVID-19-Impfung bei Personen ab 18 Jahren vom 18.11.2021, RKI – Empfehlungen der STIKO – Pressemitteilung der STIKO zur Auffrischimpfung einer COVID-19-Impfung bei Personen ab 18 Jahren (18.11.2021)
[58] D. Hüttemann, Pharmazeutische Zeitung 2021, Web-Publikation 25.11.2021,Covid-19-Impfstoff: EMA empfiehlt Comirnaty-Zulassung für Kinder | PZ – Pharmazeutische Zeitung (pharmazeutische-zeitung.de)Pharmazeutische Zeitung (pharmazeutische-zeitung.de)
[59] rbb24, Web-Publikation vom 15.12.2021, Impfung von Kindern zwischen fünf und elf Jahren in Berlin und Brandenburg gestartet | rbb24
